Tras describir el electrocardiograma y la capnografía, a continuación se explican cómo monitorizar el porcentaje de saturación de oxígeno, la temperatura y la presión arterial de forma no invasiva en pacientes anestesiados.
Pulsioximetría
La pulsioximetría mide de manera no invasiva el porcentaje de saturación de oxígeno de la hemoglobina en sangre. Emite luz a dos longitudes de onda, roja e infrarroja, las cuales pasan a través de un tejido del paciente desde un LED emisor hasta un fotodetector, midiendo la diferencia de absorbancia entre la desoxihemoglobina (luz roja) y oxihemoglobina (luz infrarroja). El flujo sanguíneo arterial es pulsátil, lo que posibilita que el pulsioxímetro mida la saturación arterial de forma específica, excluyendo sangre venosa, piel, huesos, músculo y grasa.
Este monitor aporta información sobre la saturación de oxígeno, la frecuencia de pulso y su ritmo. Actualmente la mayoría incorporan fotopletismografía que permite visualizar la onda de pulso.
Puede verse alterado por diferentes factores como el movimiento del paciente o de la pinza (figura 1), sequedad en la lengua, presión excesiva ejercida por la pinza cuando permanece mucho tiempo colocada en una misma zona, artefacto con otros aparatos eléctricos, hipotensión, vasoconstricción periférica, zonas de piel pigmentadas, luz intensa ambiental u otros tipos de hemoglobina. Sin embargo, no aporta
información sobre anemia o la perfusión de los tejidos.
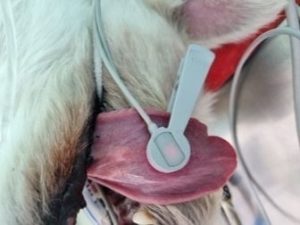
La colocación más frecuente de la sonda suele ser en la lengua (figura 2). Poner una gasa entre la lengua y el pulsioxímetro puede mejorar la calidad de la señal. En animales con pigmentación en la lengua (Chow Chow, Shar Pei), así como en determinados procedimientos en los que esta localización no es la idónea (cirugía maxilofacial, odontología, oftalmología) se puede colocar en zonas como el prepucio, la vulva, la membrana interdigital o la oreja.
Temperatura
Durante la anestesia, la temperatura corporal del paciente puede verse modificada por la depresión del centro termorregulador, el empleo de fármacos anestésicos o la existencia de patología previa, por lo tanto, es recomendable monitorizarla de manera rutinaria. La temperatura corporal normal en pequeños animales oscila entre 37,8 ºC y 39,2 ºC. Su monitorización es sencilla, y puede realizarse de forma continua a través de sondas acopladas a monitores multiparamétricos (normalmente colocadas en el esófago o en el recto) o con termómetros convencionales para realizar mediciones puntuales.
La hipotermia (temperatura corporal inferior a 37 ºC, aproximadamente) es una de las complicaciones más frecuentes durante la anestesia. Sus consecuencias incluyen el descenso del metabolismo, la infección de la herida quirúrgica, el retraso de la cicatrización, el aumento de los tiempos de coagulación, así como alteraciones cardiovasculares, respiratorias y neurológicas y la incomodidad del paciente.
Su prevención debería empezar desde la recepción del paciente y mantenerse durante todo el periodo perianestésico, empleando estrategias para reducir la pérdida de calor como evitar el contacto con superficies frías o corrientes de aire, aislándolo de elementos fríos con mantas o toallas, limitando el rasurado quirúrgico, realizando lavados con soluciones atemperadas, etc., y maximizando el aporte de calor (aire caliente, mantas eléctricas o de agua circulante, sacos de semillas calientes, etc.). Es conveniente prestar atención para no provocar quemaduras, separando o aislando los elementos emisores de calor de los pacientes convenientemente y llevando a cabo la monitorización frecuente de la temperatura corporal.
La aparición de hipertermia (temperatura corporal superior a 40 ºC) durante el periodo perioperatorio es infrecuente, pero sus consecuencias son igualmente importantes en los pacientes, pudiendo llegar a provocar taquiarritmias, taquipnea, hipoxia, fallo multiorgánico e incluso la muerte en casos graves. Puede estar causada por determinados fármacos, el empleo de circuitos circulares con bajos flujos de gas fresco, animales con pelaje denso o una temperatura ambiental elevada. Su tratamiento incluye el enfriamiento activo del paciente con fluidoterapia o aire frío, aumento del flujo de gas fresco o uso de sistemas abiertos y el empleo de una fracción inspirada de oxígeno del 100 %.
Presión arterial no invasiva
El control de la presión arterial es fundamental para garantizar una buena perfusión y oxigenación tisular, así como prevenir complicaciones intra y posanestésicas. En perros y gatos los valores normales durante la anestesia oscilan entre 90-120 mmHg de presión sistólica (PAS), 60-100 mmHg de media (PAM), y 55-90 mmHg de diastólica. Es posible medir la presión arterial de manera invasiva cateterizando una arteria periférica o de manera no invasiva mediante un manguito colocado en una extremidad o la base de la cola.
La monitorización no invasiva es sencilla pero poco precisa y puede verse alterada en ciertas situaciones, como con hipovolemia o con vasoconstricción. Puede realizarse mediante el método oscilométrico o mediante Doppler. En ambos casos se coloca un manguito en la cola o una extremidad del paciente que se infla, de manera que colapsa una arteria. Posteriormente, se vacía lentamente, detectando la presión a la que la sangre vuelve a fluir por dicho vaso mediante un manómetro. El método oscilométrico infla el manguito de manera automática y proporciona valores de presión arterial sistólica, media y diastólica.
El método Doppler requiere el inflado y desinflado del manguito de manera manual y el paso de la sangre a través de la arteria se detecta gracias a una señal audible proporcionada por un sensor colocado sobre la proyección de la arteria. El valor que se obtiene es el de la presión arterial sistólica. Para prevenir errores en la medición, los manguitos utilizados deben tener aproximadamente el 40 % de la circunferencia de la extremidad donde se colocan; si son más pequeños pueden sobrestimar la PA, y los más grandes la pueden subestimar. La extremidad en la que se coloca el manguito debe estar a la altura del corazón, si está más alta se debe sumar 7,5 mmHg por cada 10 cm de altura y restarlo en caso de que esté más baja.
La hipotensión (PAM <60 mmHg o PAS <80 mmHg) es una complicación muy frecuente. Entre sus causas encontramos hipovolemia, vasodilatación, cardiopatía o aumento del tono vagal. El déficit de perfusión puede provocar lesión renal, cerebral y cardiaca.
La hipertensión (PAM >120 mmHg) es menos frecuente y puede estar causada por nocicepción, hipoxia, hipercapnia, enfermedades preexistentes o por el uso de algunos fármacos. Durante periodos prolongados puede provocar retinopatías, isquemia miocárdica, arritmias o daño renal. Lo más frecuente es que surja como consecuencia de un estímulo nociceptivo durante la cirugía.
Bibliografía
- Baker SJ, Pulse oximetry. En: Ehrenwert J, Eisenkraft J, Berry J (editores). Anesthesia equipment principles and applications. USA: Elsevier Saunders. 2013; p. 256-272.
- Bednarski R, Grimm K, Harvey R. AAHA Anesthesia Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2011; 47(6):377-385.
- Brodbelt DC, Pfeiffer DU, Young LE, et al. Risk factors for anaesthetic related death in cats, results from the confidential enquiry into perioperative small animal fatalities (CEPSAF). Br J Anaesth. 2007; 99(5):617–23.
- Clark-Price S. Inadvertent Perianesthetic Hypothermia in Small Animal Patients. Vet Clin Small Anim. 2015; 45(5):983-94.
- Duke-Novakovski T, Carr A. Perioperative Blood Pressure Control and Management. Vet Clin Small Anim. 2015; 45(5):965-81.
- Egger C. Anaesthetic complications, accidents and emergencies. En: Duke-Novakovski T, de Vries M, Seymor C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Gloucester: British Small Animal Veterinary Assotiation. 2016; p. 428-444.
- Gil L, Redondo JI. Canine anaesthetic death in Spain: a multicentre prospective cohort study of 2012 cases. Vet Anaesth Analg; 2013:40(6):e57-67.
- Grubb T, Sager J, Gaynor JS, Montgomery E, Parker JA, Shafford H, Tearney C. AAHA Anesthesia and Monitoring Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2020; 56(2); p. 59-82.
- Haskins SC. Monitoring anesthetized patients. En: Lumb and Jones. Veterinary anesthesia and analgesia. USA: Willey Blackwell. 2015; p. 100-108.
- Martínez Fernández MA, Martínez Taboada F. Monitorización del sistema respiratorio. En: Sández Cordero I. Manual clínico de Monitorización Anestésica en pequeños animales. España: Servet. 2019; p. 61-72.
- Martínez Pino J. Monitorización ventilatoria. En: Martínez Pino J. Manual de Ventilación Mecánica en pequeños animales. España: Multimédica Ediciones Veterinarias. 2018; p. 50-53.
- Matthews NS, Mohn TJ, Yang M, et al. Factors associated with anesthetic-related death in dogs and cats in primary care veterinary hospitals. J Am Vet Med Assoc. 2017; 250(6):655–66.
- Mosing M. General principles of perioperative care. En: Duke-Novakovski T, de Vries M, Seymor C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Gloucester: British Small Animal Veterinary Assotiation. 2016; p. 16-23.
- Rodriguez-Diaz J, Hayes G, Boesch J. Decreased incidence of perioperative inadvertent hypothermia and faster anesthesia recovery with increased environmental temperature: A nonrandomized controlled study. Vet Surg. 2019; 49(2): p. 1-9.
- Sandez Cordero I. Manual clínico de monitorización anesésica en pequeños animales. España: Servet. 2019; p. 1-16.
- Schauvliege S. Patient monitoring and monitoring equipment. En: Duke-Novakovski T, de Vries M, Seymor C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Gloucester: British Small Animal Veterinary Assotiation. 2016; p. 77-96.